Modelo Atômico de Rutheford-Bohr
Niels Bohr prospôs seu modelo atômico inicialmente para o átomo de hidrogênio, e por esse trabalho, recebeu o prêmio nobel em 1922.
O cientista dinamarquês, especializado em Física, Niels Bohr, realizou algumas observações referentes ao estudo a luz e, baseado em suas conclusões, e ele pôde aprimorar o modelo de Rutheford.
O modelo atômico de Rutheford-Bohr fico assim conhecido pporque Bohr manteve as principais características, porém acrescentou mais informações ao estudo dos elétrons que ficavam ao redor do núcleo.
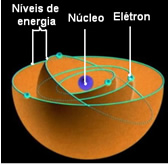
Segundo Bohr, os elétrons só podem permanecer em determinadas órbitas que possuem deterninados estados de energia fixo, constante; pois os elétrons recebem e emitem o que Max Planck chamou de quanta, ou seja, pacote discretos de energia. Isso significa que cada órbita do átomo contém uma determinada quantidade de energia, só o elétron que possui aquela quantidade de energia e que pode permanecer ali. Quanto mais próximo do núcleo, menor será essa energia.
O estado de menor energia em que o elétron se encontra é denominado de estado fundamental. Esse elétron só poderá passar para um estado de maior energia, ou seja, para uma órbita mais externa ao núcleo, se ele receber uma quantidade necessária de energia. Se isso acontecer ele estará em seu estado excitado, que é muito mais instável.
Quando esse elétron retorna ao seu estado mais estável, que é o fundamental, ele emite certa quantidade de energia radiante, que pode ser vista na forma de luz.
Essas órbitas permitidas para os elétrons foram denominadas de, níveis ou camadas de energética ou eletrônicas e foram definidas como sendo no máximo sete, que podem também ser representadas, respectivamente, do mais interno para o mais externo, pelas letras: K,L,M,N,O,P e Q.
Cada elemento apresenta diferente valores de energia para suas camadas de energia, é por isso que cada elemento possui um espectro diferente de cor na liberação de radiação eletromagnética em forma de luz visível.
Quando esse elétron retorna ao seu estado mais estável, que é o fundamental, ele emite certa quantidade de energia radiante, que pode ser vista na forma de luz.
Essas órbitas permitidas para os elétrons foram denominadas de, níveis ou camadas de energética ou eletrônicas e foram definidas como sendo no máximo sete, que podem também ser representadas, respectivamente, do mais interno para o mais externo, pelas letras: K,L,M,N,O,P e Q.
Cada elemento apresenta diferente valores de energia para suas camadas de energia, é por isso que cada elemento possui um espectro diferente de cor na liberação de radiação eletromagnética em forma de luz visível.
por Jennifer Rocha



.jpg)





0 comentários:
Postar um comentário