PROPRIEDADES PERIÓDICAS E APERIÓDICAS
Muitas propriedades dos elementos químicos vaiam periodicamente ao longo da Tabela periódica. São as chamadas Propriedades Periódicas.
As propriedades periódicas podem ser: raio atômico, volume atômico, densidade absoluta, eletronegatividade, eletropositividade, eletroafinidade.
Esse fato obedece a Lei da Periodicidade de Moseley:
“Muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência de seus números atômicos.”
Para as propriedades onde os valores só aumentam com o número atômico e outras onde os valores só diminuem chamamos de Propriedades Aperiódicas. São propriedades aperiódicas, o calor específico.
As propriedades periódicas podem ser: raio atômico, volume atômico, densidade absoluta, eletronegatividade, eletropositividade, eletroafinidade.
Esse fato obedece a Lei da Periodicidade de Moseley:
“Muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência de seus números atômicos.”
Para as propriedades onde os valores só aumentam com o número atômico e outras onde os valores só diminuem chamamos de Propriedades Aperiódicas. São propriedades aperiódicas, o calor específico.
Raio Atômico
O raio atômico dos elementos é uma propriedade periódica porque seus valores só variam periodicamente, ou seja, aumentam e diminuem seguidamente, com o aumento do número atômico.
O raio atômico (r) é a metade da distância internuclear mínima (d) que dois átomos desse elemento podem apresentar, sem estarem ligados quimicamente.
Para medir o raio atômico, usa-se a técnica da difração por Raios-X.
O raio atômico (r) é a metade da distância internuclear mínima (d) que dois átomos desse elemento podem apresentar, sem estarem ligados quimicamente.
Para medir o raio atômico, usa-se a técnica da difração por Raios-X.

Em uma família, da tabela periódica, o raio atômico aumenta de cima para baixo e no período aumenta da direita para esquerda.
Para esta regra não é admitido os gases nobres, já que possuem o maior raio atômico em cada período.
Observando a tabela periódica, podemos verificar que o frâncio (Fr) tem maior raio atômico.
Se o átomo se transforma em íon cátion ou ânion, o seu raio sofre alteração.
- o raio do átomo é sempre maior que o raio do seu íon cátion porque perde elétrons.
- o raio do átomo é sempre menor que o raio do seu íon ânion porque ganha elétrons.
Para esta regra não é admitido os gases nobres, já que possuem o maior raio atômico em cada período.
Observando a tabela periódica, podemos verificar que o frâncio (Fr) tem maior raio atômico.
Se o átomo se transforma em íon cátion ou ânion, o seu raio sofre alteração.
- o raio do átomo é sempre maior que o raio do seu íon cátion porque perde elétrons.
- o raio do átomo é sempre menor que o raio do seu íon ânion porque ganha elétrons.
Volume Atômico
O volume atômico é uma propriedade periódica porque varia periodicamente com o aumento do número atômico.
Volume atômico é a relação entre a massa de uma quantidade de matéria (1 mol = 6,02.1023 átomos ) e a densidade da substância simples formada por esse elemento na fase sólida.
Não é o volume de um átomo, mas de um conjunto de átomos. No volume atômico influi não só o volume de cada átomo, como também o espaçamento que existe entre esses átomos.
Na tabela periódica, os valores do volume atômico aumentam de cima para baixo nas famílias e em um período, do centro para as extremidades da tabela.
Volume atômico é a relação entre a massa de uma quantidade de matéria (1 mol = 6,02.1023 átomos ) e a densidade da substância simples formada por esse elemento na fase sólida.
Não é o volume de um átomo, mas de um conjunto de átomos. No volume atômico influi não só o volume de cada átomo, como também o espaçamento que existe entre esses átomos.
Na tabela periódica, os valores do volume atômico aumentam de cima para baixo nas famílias e em um período, do centro para as extremidades da tabela.
Densidade Absoluta
Densidade ou Massa Específica é a relação entre a massa (m) de uma substância e o volume (V) ocupado por essa massa.
Esta variação, no estado sólido é uma propriedade periódica.
Na tabela periódica, os valores de densidades aumentam, nas famílias de cima para baixo e nos períodos, das extremidades para o centro.
Desta forma, pode-se notar que os elementos mais densos estão no centro e na parte de baixo da tabela periódica.
Exemplos:
- Os (ósmio) – d=22,5g/mL
- Ir (irídio) – d=22,4g/mL
Na tabela periódica, os valores de densidades aumentam, nas famílias de cima para baixo e nos períodos, das extremidades para o centro.
Desta forma, pode-se notar que os elementos mais densos estão no centro e na parte de baixo da tabela periódica.
Exemplos:
- Os (ósmio) – d=22,5g/mL
- Ir (irídio) – d=22,4g/mL

Ponto de Fusão e Ponto de Ebulição
Ponto de Fusão é a temperatura onde a matéria passa da fase sólida para a fase líquida.
Ponto de Ebulição é a temperatura onde a matéria passa da fase líquida para a gasosa.
Na tabela periódica, os valores de PF e de PE variam numa família, à esquerda da tabela, aumenta de baixo para cima e à direta da tabela, aumenta de cima para baixo. Nos períodos, aumenta das extremidades para o centro.
Na tabela periódica há elementos de diferentes estados físicos.
- fase gasosa: H, N, O, F, Cl, Ne, Ar, Kr, Xe, RN
- fase líquida: Hg e Br
- fase sólida: demais elementos
Ponto de Ebulição é a temperatura onde a matéria passa da fase líquida para a gasosa.
Na tabela periódica, os valores de PF e de PE variam numa família, à esquerda da tabela, aumenta de baixo para cima e à direta da tabela, aumenta de cima para baixo. Nos períodos, aumenta das extremidades para o centro.
Na tabela periódica há elementos de diferentes estados físicos.
- fase gasosa: H, N, O, F, Cl, Ne, Ar, Kr, Xe, RN
- fase líquida: Hg e Br
- fase sólida: demais elementos
Imagine os elementos:
X = fase sólida
Y = fase líquida
Z = fase gasosa
Y = fase líquida
Z = fase gasosa
Então, temos:
X com PF e PE maior que Y e Y com PF e PE maior que Z
O carbono (C) é uma exceção para esta regra. Possui PF igual a 3800°C.
O tungstênio (W) é o metal com maior PF, 3422°C, sendo utilizado em filamentos de lâmpadas incandescentes.
O tungstênio (W) é o metal com maior PF, 3422°C, sendo utilizado em filamentos de lâmpadas incandescentes.
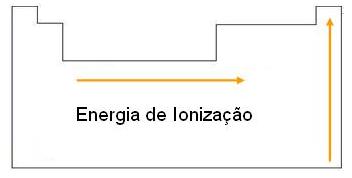
Potencial de Ionização
É a energia mínima necessária para “arrancar” um elétron de um átomo isolado no seu estado gasoso.
O primeiro potencial de ionização é considerado o mais importante porque é a energia necessária para “arrancar” o primeiro elétron da camada mais externa do átomo.
De acordo com o SI (Sistema Internacional) deve-se ser expresso em Kj/mol.
O potencial de ionização é uma propriedade periódica, que na tabela periódica, se comporta exatamente ao contrário do raio atômico.
Quanto maior o raio atômico, menor a atração do núcleo com o seu elétron mais afastado. Então é mais fácil de “arrancar” o elétron. Consequentemente é menor a energia de ionização.
O potencial de ionização aumenta, nas famílias de baixo para cima e nos períodos da esquerda para a direita.
O primeiro potencial de ionização é considerado o mais importante porque é a energia necessária para “arrancar” o primeiro elétron da camada mais externa do átomo.
De acordo com o SI (Sistema Internacional) deve-se ser expresso em Kj/mol.
O potencial de ionização é uma propriedade periódica, que na tabela periódica, se comporta exatamente ao contrário do raio atômico.
Quanto maior o raio atômico, menor a atração do núcleo com o seu elétron mais afastado. Então é mais fácil de “arrancar” o elétron. Consequentemente é menor a energia de ionização.
O potencial de ionização aumenta, nas famílias de baixo para cima e nos períodos da esquerda para a direita.
Eletronegatividade
É a tendência que um átomo tem de atrair elétrons. É muito característico dos não-metais. Linus Pauling, através de experimentos, tentou quantificar esta tendência e criou uma escala de eletronegatividade. Essa escala existe em muitas tabelas periódicas.
A eletronegatividade aumenta conforme o raio atômico diminui. Quanto maior o raio atômico, menor será a atração do núcleo pelos elétrons mais afastados e então, menor a eletronegatividade.
Na tabela periódica, os gases nobres não são considerados, já que não tem tendência a ganhar ou perder elétrons. Já estão estabilizados.
A eletronegatividade aumenta nas famílias, de baixo para cima e nos períodos da esquerda para a direita.
O elemento mais eletronegativo é o flúor (F), com valor de eletronegatividade 3,98.
A eletronegatividade aumenta conforme o raio atômico diminui. Quanto maior o raio atômico, menor será a atração do núcleo pelos elétrons mais afastados e então, menor a eletronegatividade.
Na tabela periódica, os gases nobres não são considerados, já que não tem tendência a ganhar ou perder elétrons. Já estão estabilizados.
A eletronegatividade aumenta nas famílias, de baixo para cima e nos períodos da esquerda para a direita.
O elemento mais eletronegativo é o flúor (F), com valor de eletronegatividade 3,98.
Eletroafinidade ou Afinidade Eletrônica
É a quantidade de energia liberada quando um átomo isolado no seu estado fundamental (fase gasosa) recebe 1é.
Um átomo isolado no seu estado fundamental pode receber 1é, transformando-se em um ânion. Isso pode levar ao átomo um estado de maior estabilidade e então ocorre a liberação de energia.
Um átomo isolado no seu estado fundamental pode receber 1é, transformando-se em um ânion. Isso pode levar ao átomo um estado de maior estabilidade e então ocorre a liberação de energia.
A afinidade eletrônica aumenta conforme o raio atômico diminui. É importante para os não-metais. Os elementos mais eletroafins são os halogênios e o oxigênio.
A eletroafinidade, na tabela periódica, aumenta nas famílias de baixo para cima e nos períodos da esquerda para a direita.
Seus valores são dados em Kj/mol e são muito difíceis de serem medidos.
A eletroafinidade, na tabela periódica, aumenta nas famílias de baixo para cima e nos períodos da esquerda para a direita.
Seus valores são dados em Kj/mol e são muito difíceis de serem medidos.
Eletropositividade
É a tendência que um átomo tem de perder elétrons. É muito característico dos metais. Pode ser também chamado de caráter metálico. É o inverso da eletronegatividade.
A eletropositividade aumenta conforme o raio atômico aumenta.
Quanto maior o raio atômico, menor será a atração do núcleo pelo elétron mais afastado, maior a facilidade do átomo em doar elétrons, então, maior será a eletropositividade.
Os gases nobres também não são considerados, por conta da sua estabilidade.
A eletropositividade aumenta nas famílias, de cima para baixo, e nos períodos, da direita para a esquerda.
O elemento mais eletropositivo é o frâncio (Fr), que possui eletronegatividade 0,70.
A eletropositividade aumenta conforme o raio atômico aumenta.
Quanto maior o raio atômico, menor será a atração do núcleo pelo elétron mais afastado, maior a facilidade do átomo em doar elétrons, então, maior será a eletropositividade.
Os gases nobres também não são considerados, por conta da sua estabilidade.
A eletropositividade aumenta nas famílias, de cima para baixo, e nos períodos, da direita para a esquerda.
O elemento mais eletropositivo é o frâncio (Fr), que possui eletronegatividade 0,70.
REATIVIDADE
A reatividade de um elemento químico está associada à sua maior ou menor facilidade em ganhar ou perder elétrons. Assim, os elementos mais reativos serão tantos os metais que perdem elétrons com maior facilidade, quanto os ametais que ganham elétrons com maior facilidade.

Pela figura podemos observar que:
a) entre os metais, o mais reativo é o frâncio (Fr)
b) entre os ametais, o mais reativo é o flúor (F).
(Só química)
(Só química)











0 comentários:
Postar um comentário